 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知下列电对的标准电极电势:在酸性溶液中分别用1.0mol·L-1Fe2+,1.0mol·L-1
已知下列电对的标准电极电势:
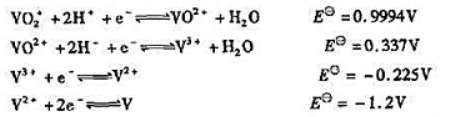
在酸性溶液中分别用1.0mol·L-1Fe2+,1.0mol·L-1Sn2+和Zn还原1.0mol·L-1的VO2+时,最终得到的产物各是什么(不必计算)?
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知下列电对的标准电极电势:
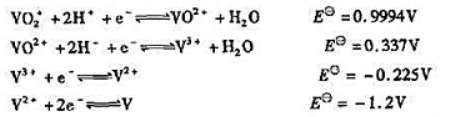
在酸性溶液中分别用1.0mol·L-1Fe2+,1.0mol·L-1Sn2+和Zn还原1.0mol·L-1的VO2+时,最终得到的产物各是什么(不必计算)?
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“已知下列电对的标准电极电势:在酸性溶液中分别用1.0mol·…”相关的问题
更多“已知下列电对的标准电极电势:在酸性溶液中分别用1.0mol·…”相关的问题
A.电对Fe3+/Fe2+做正极
B.反应Fe+2Fe3+=3Fe2+的平衡常数大约为8×1040
C.电池组成式为(-)Fe|Fe2+(c1)||Fe2+(c2),Fe3+(c3)|Pt()
D.电池的标准电动势为0.331V
在电对 中,如果H+浓度增大,电极电势增大的是(),电极电势不变的是()。
中,如果H+浓度增大,电极电势增大的是(),电极电势不变的是()。
酸的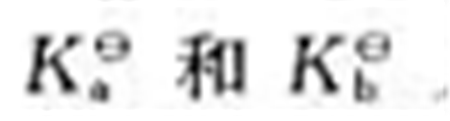 几乎相等,试判断甘氨酸在强酸性溶液、强碱性溶液和纯水中主要以何种离子存在。
几乎相等,试判断甘氨酸在强酸性溶液、强碱性溶液和纯水中主要以何种离子存在。
用下列电池按直接电位法测定草酸根离子浓度。
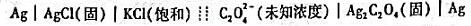
(1)推导出pC2O4与电池电动势之间的关系式
(2)若将一未知浓度的草酸钠溶液置入此电池,在25℃时测得电池电动势为0.402V,Ag-AgCl电极为负极,计算未知溶液的pC2O4。(已知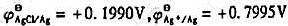 )
)
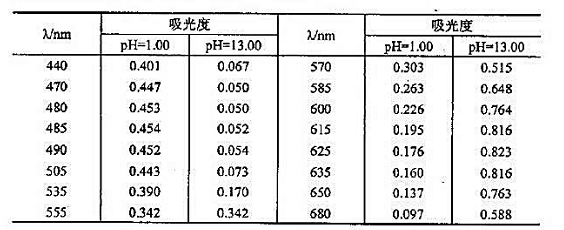
(1)指示剂酸型是什么颜色?在酸性介质中测定时应选什么颜色的滤光片?在强碱性介质中测定时应选什么波长?
(2)绘制指示剂酸式和诚式离子的吸收曲线.
(3)当用2cm比色皿在590nm处测量强碱性介质中指示剂浓度为1.00x10-4mol·L-1溶液时吸光度为多少?
(4)若题设溶液在485nm处,用1cm比色m测得吸光度为0.309.此染液pH为多少?如在555m测定,此溶液吸光度是多少?
(5)在什么波长处测定指示剂的吸光度与pH无关?为什么?
(6)欲用标准曲线法测定指示剂总浓度,需选择什么实验条件才能使标准由线不偏高比尔定律?
已知在1mol·L-1HC 1介质中,Fe(III)/Fe(II) 电对的Eθ=0.70V.
Sn(Ⅳ)/Sn(Ⅱ)电对的Eθ=0.14V.求在此条件下,反应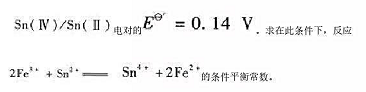 的条件平衡常数。
的条件平衡常数。