 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
下列反应可用离子方程式“H++OH﹣=H2O”表示的是()
A.HNO3溶液与KOH溶液混合
B.NH4Cl溶液与Ca(OH)2溶液混合
C.NaHSO4溶液与Ba(OH)2溶液混合
D.H3PO4溶液与NaOH溶液混合
 答案
答案
A、HNO3溶液与KOH溶液混合
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
A.HNO3溶液与KOH溶液混合
B.NH4Cl溶液与Ca(OH)2溶液混合
C.NaHSO4溶液与Ba(OH)2溶液混合
D.H3PO4溶液与NaOH溶液混合
 答案
答案
A、HNO3溶液与KOH溶液混合
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“下列反应可用离子方程式“H++OH﹣=H2O”表示的是()”相关的问题
更多“下列反应可用离子方程式“H++OH﹣=H2O”表示的是()”相关的问题
A.硝酸银与盐酸;硝酸银与氯化钠
B.盐酸与碳酸钙;盐酸与碳酸钠
C.氯化钡与硫酸钠;氢氧化钡与硫酸
D.氢氧化钾与硫酸镁;氢氧化钡与硫酸镁
A.将氨水滴入到FeCl3溶液中 Fe3++3OH- = Fe(OH)3↓
B.氧化铁与盐酸反应 Fe2O3+6H+ = 2Fe3++3H2O
C.向FeCl3溶液中加入铁粉 Fe+Fe3+ = 2Fe2+
D.向氯化亚铁溶液中通入Cl2 Fe2++Cl2 = Fe3++2Cl-
A.氧化产物是SO42-
B.氧化剂与还原剂的物质的量之比是1:3
C.r2O72-表现了氧化性
D.还原1molCr2O72−,电子转移3 mol
A.将铜丝插入稀硝酸中:Cu+4H++2NO =Cu2++2NO2↑+H2O
B.向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe=2Fe2+
C.向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH
D.向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+
A.该溶液中,H+、NH4+、SO42-、I–可以大量共存
B.该溶液中,Ag+、K+、NO3-、CH3CHO可以大量共存
C.向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:Fe2++ClO-+2H+= Cl-+Fe3++H2O
D.向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023个
A.MnO4—+S2-+4H+=MnO2+S
B.2MnO4—+5S2-+16H+=2Mn2++5S↓+8H2O↑+2H2O
C.MnO4—+S2-+4H+=Mn2++SO2
D.2MnO4—+S2-+4H+=2MnO4—+SO2↑+2H2O
完成并配平下列化学反应方程式:
(1)过氧化氢在碱性介质中氧化亚铬酸根离子;
(2)过氧化氢的浓溶液与氢氧化钡作用;
(3)氧化银在碱性介质中氧化过氧化氢;
(4)二价锰离子催化分解过氧化氢;
(5)高锰酸钾的酸性溶液与过氧化氢作用;
(6)在高温下硫单质与碳作用;
(7)点燃硫粉与铁粉的混合物;
(8)单质硫置于氢氧化钠中共热;
(9)硫化氢与单质溴反应;
(10)将硫化氢气体通入三价铁离子的溶液中;
(11)单质铜与浓硫酸作用;
(12)二硫化锡、硫化汞分别溶于硫化钠溶液中;
(13)以五氧化二钒为催化剂利用空气中的氧气氧化二氧化硫;
(14)隔绝空气加热亚硫酸钠固体;
(15)硫酸氢钠受强热脱水;
(16)灼烧过的氧化铝与焦硫酸钾共熔;
(17)氯磺酸与水作用;
(18)沸腾的亚硫酸钠溶液与硫粉反应;
(19)向硫化钠和碳酸钠的混合溶液中通入二氧化硫气体;
(20)溴化银溶于硫代硫酸钠溶液中;
(21)过二硫酸钾受热分解;
(22)碲化铝的水解;
(23)过氧化氢氧化二氧化碲。
某氮肥厂氨氮废水中的氮元素多以NH和NH3·H2O的形式存在,该废水的处理流程如下:![]()
问题一、过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30℃,通空气将氨赶出并回收。
①用离子方程式表示加NaOH溶液的作用:()。
②用化学平衡原理解释通空气的目的:()。
问题二、过程Ⅱ:在微生物作用的条件下,NH经过两步反应被氧化成NO。两步反应的能量变化示意图如下:
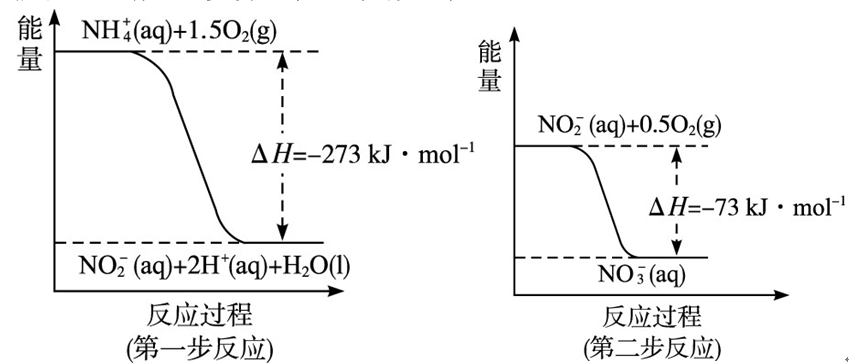
①第一步反应是()反应(选填“放热”或“吸热”),判断依据是()。
②1molNH(aq)全部氧化成NO(aq)的热化学方程式是()。
问题三、过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3复原成N2。假设该反应消耗32gCH3OH转移6mol电子,则参加反应的复原剂和氧化剂的物质的量之比是()。